- Cadastre-se
- Equipe
- Contato Brasil, 26 de abril de 2024 04:36:12
 Em Tempo Real
Em Tempo Real
-
27/04/2021 07h38
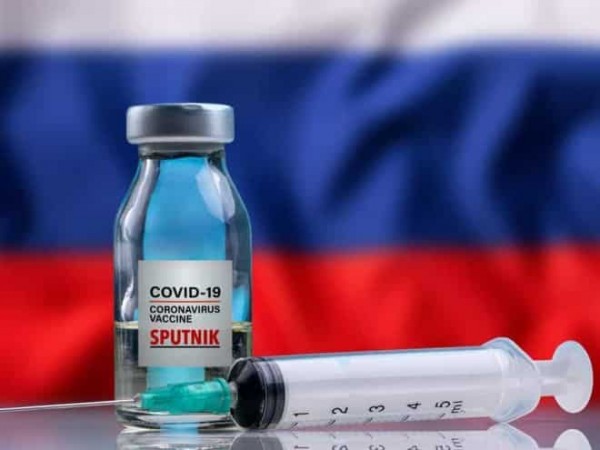
VACINAS: Em dia decisivo para Sputnik V na Anvisa, Consórcio Nordeste divulga documento defendendo a importação do imunizante produzido na Rússia
Veja maisFoto: Arquivo da Política Real
( Publicada originalmente às 17h 45 do dia 26/04/2021)
(Brasília-DF, 27/04/2021) No dia em que a Diretoria Colegiada da Anvisa (Agência Nacional de Vigilância Sanitária) iria decidir sobre se autoriza ou não a importação da vacina Sputnik V o Consórcio Nordeste e o seu Comitê Científico divulgou documento defendendo a importação da vacina Sputnik V desenvolvida pelo Instituto Gamaleya controlado pelo Fundo Soberando da Rússia.
Veja o documento:
Comitê Científico recomenda importação e uso da vacina SPUTNIK-V pelos Estados do Nordeste
As vacinas continuam sendo as grandes esperanças do combate à pandemia COVID-19, que já levou a mais de 3,5 milhões de mortes desde o seu início. A disponibilização de vacinas para uso de forma emergencial representa uma mudança fundamental na trajetória tradicional de liberação de imunizantes, que, tradicionalmente, levam em média mais de 10 anos para sua implementação. Além disso, novos paradigmas foram necessários, envolvendo adaptações nas fases de desenvolvimento, processos regulatórios e capacidade de fabricação em larga escala devido a gravidade da pandemia
Uma das maiores agências regulatórias em saúde, a americana Food and Drug Administration (FDA) declarou, em junho de 2020, que para a aprovação de uma vacina deve haver comprovação de redução da ocorrência e gravidade da doença em pelo menos 50% dos pacientes. A Organização Mundial da Saúde (OMS) também estabeleceu estes limites para liberação das vacinas COVID.
Os ensaios clínicos de fase 3 têm como desfecho principal a avaliação de eficácia do produto, através de estudos controlados, randomizados, envolvendo milhares de pacientes. Após a publicação desses dados, a vacina candidata é submetida à avaliação pelas agências reguladoras, para posterior produção e distribuição. Por fim, os estudos de fase 4, ou de pós-licenciamento, estimam os efeitos e eventos adversos após a utilização da vacina em larga escala na população alvo.
A maioria das vacinas para a COVID-19 disponíveis atualmente induzem anticorpos neutralizantes contra as subunidades virais, a maioria delas tendo como alvo a região RBD (do inglês domínio de ligação do receptor) da proteína mais antigênica do vírus, a Spike (S), impedindo assim, a captação do vírus pelo receptor ACE2 (enzima conversora da angiotensina 2) humano. O surgimento de novas variantes tem assumido um papel relevante nas discussões, em função de seu potencial de escape da resposta imune induzida pela infecção natural ou pela imunização e será fundamental com qualquer vacina autorizada o monitoramento da efetividade e dos eventos adversos após o uso em larga escala.
Temos em uso no mundo três vacinas que utilizam a tecnologia de vetores virais com adenovírus não replicantes. Podem ser humanos (Ad5 e Ad26) ou símios (Chipanzés ChAd).
A vacina ChAdOx1 nCoV-19, desenvolvida na Universidade de Oxford, na Inglaterra, em parceria com o laboratório AstraZeneca, induz robusta resposta imune, incluindo resposta celular, após a aplicação de duas doses e teve sua aprovação para uso emergencial no Brasil.
A vacina do laboratório americano Johnson&Johnson também utiliza o Ad26. Estudo de fase 3 mostrou que a vacina Janssen é segura e efetiva na prevenção de COVID em adultos com uma única dose em conservação tradicional.
Também com a tecnologia de vetores virais temos a vacina produzida pelo Instituto Gamaleya, de Moscou, a Sputnik V. A vacina utiliza como vetores virais o Ad26 na primeira e o Ad5 na segunda dose.
O Consorcio Nordeste e os nove governos estaduais que o integram, extremamente preocupados com as dificuldades de disponibilidade de vacinas para o Brasil, conseguiu avançar na negociação de doses deste Instituto para o país e aguarda a aprovação da ANVISA para que possamos contar com mais uma opção de vacina.
Os estudos publicados de fase 2 da vacina Sputnik-V testaram duas formulações baseadas em dois subtipos do adenovírus e todos os participantes produziram anticorpos contra a glicoproteína do SARS-CoV-2, com uma taxa de soroconversão de 100% após 42 dias da aplicação. Também foi avaliada a resposta celular no 28o dia, com detecção de proliferação de linfócitos T CD4 e CD8 em todos os estudados.
O estudo de fase 3 teve como desfecho primário analisar a proporção de participantes com COVID-19 confirmado por PCR a partir do dia 21 após receber a primeira dose, mostrou que dos 14.964 participantes no grupo da vacina, 16 (0,1%) tiveram a doença, comparando com 62 (1,3%) dos 4.902 no grupo do placebo. A Eficácia da vacina foi de 91,6% (IC 95% 85,6–95,2), e já está aprovada e em uso em diversos países. A Argentina e a Hungria já anunciaram resultados iniciais de efetividade com esta vacina e foram bastante promissores. Na Hungria, onde foram administradas mais de 200 mil doses, a resposta desta vacina foi superior a de outras plataformas. O monitoramento de eventos adversos na Argentina comprovou os dados do estudo de fase 3, onde a maioria dos eventos adversos foram considerados leves, tornando a possibilidade de o Brasil contar com uma vacina imunogênica e segura.
Diante desta pandemia, não podemos deixar que entraves burocráticos prejudiquem o acesso da população a uma vacina que comprovou sua eficácia, segurança e com real garantia de disponibilidade, como a Sputnik-V, pelo esforço do Consorcio Interestadual de Desenvolvimento Sustentável do Nordeste.
Referências:
- Gao Q, Bao L, Mao H, et al. Rapid development of an inactivated vaccine candidate for SARS- CoV-2. Science. 2020:eabc1932.
- World Health Organization (WHO). COVID‐19 situation dashboard of World Health Organization. 2021. Disponível em https://covid19.who.int/ Acessado em abril 2021.
- Yamey G, Schaferhoff M, Hatchett R, et al. Ensuring global access to COVID-19 vaccines. Lancet. 2020;395(10234):1405-1406.
- Lurie N, Saville M, Hatchett R, Halton J. Developing Covid-19 Vaccines at Pandemic Speed. N Engl J Med. 2020;382(21):1969-1973.
- Sharpe HR, Gilbride C, Allen E, et al. The early landscape of coronavirus disease 2019 vaccine development in the UK and rest of the world. Immunology. 2020;160(3):223-232.
- Thanh Le T, Andreadakis Z, Kumar A, et al. The COVID-19 vaccine development landscape. Nat Rev Drug Discov. 2020;19(5):305-306.
- U.S. Department of Health and Human Services, Food and Drug Administration, Center for Biologics Evaluation and Research. Development and Licensure of Vaccines to Prevent COVID- 19. 2021. Disponível em https://www.fda.gov/regulatory-information/search-fda-guidance- documents/development-and-licensure-vaccines-prevent-covid-19 Acessado em abril 2021.
- Stevanim LF. Como nasce uma vacina. Radis - Fiocruz 2020;2016:18-19.
- Mukherjee R. Global efforts on vaccines for COVID-19: Since, sooner or later, we all will catch
the coronavirus. Journal of biosciences. 2020;45(1).
- Caddy S. Developing a vaccine for covid-19. BMJ. 2020;369:m1790.
- Krammer F. SARS-CoV-2 vaccines in development. Nature. 2020;586(7830):516-527.
- Folegatti PM, Ewer KJ, Aley PK, et al. Safety and immunogenicity of the ChAdOx1 nCoV-19
vaccine against SARS-CoV-2: a preliminary report of a phase 1/2, single-blind, randomised
controlled trial. Lancet. 2020;396(10249):467-478.
- Voysey M, Clemens SAC, Madhi SA, et al. Safety and efficacy of the ChAdOx1 nCoV-19 vaccine
(AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil,
South Africa, and the UK. Lancet. 2021;397(10269):99-111.
- Ramasamy MN, Minassian AM, Ewer KJ, et al. Safety and immunogenicity of ChAdOx1 nCoV-19
vaccine administered in a prime-boost regimen in young and old adults (COV002): a single-
blind, randomised, controlled, phase 2/3 trial. Lancet. 2021;396(10267):1979-1993.
- Souza WM, Amorim MR, Sesti-Costa R, et al. Levels of SARS-CoV-2 Lineage P.1 Neutralization by
Antibodies Elicited after Natural Infection and Vaccination [Preprint]. Lancet. 2021.
- Janssen Investigational COVID-19 Vaccine: Interim Analysis of Phase 3 Clinical Data Released. 2021. Disponível em https://www.nih.gov/news-events/news-releases/janssen-investigational-
covid-19-vaccine-interim-analysis-phase-3-clinical-data- released#:~:text=An%20investigational%20COVID%2D19%20vaccine,The%20vaccine%2C%20ca lled%20Ad Acessado em abril 2021.
- Zhu FC, Li YH, Guan XH, et al. Safety, tolerability, and immunogenicity of a recombinant adenovirus type-5 vectored COVID-19 vaccine: a dose-escalation, open-label, non-randomised, first-in-human trial. Lancet. 2020;395(10240):1845-1854.
- Logunov DY, Dolzhikova IV, Zubkova OV, et al. Safety and immunogenicity of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine in two formulations: two open, non- randomised phase 1/2 studies from Russia. Lancet. 2020;396(10255):887-897.
- Science Brief: Emerging SARS-CoV-2 Variants. 2021. Disponível em https://www.cdc.gov/coronavirus/2019-ncov/more/science-and-research/scientific-brief- emerging-variants.html Acessado em abril 2021.
Comitê Científico do Nordeste
Coordenação: Sergio Rezende e Carlos Gabas
Membros: Adélia Carvalho de Melo Pinheiro (BA); José Noronha (PI); Luiz Cláudio Arraes de Alencar (PE); Sinval Brandão Filho (PE); Marco Aurélio Góes (SE); Marcos Pacheco (MA); Maurício Barreto (BA); Priscilla Karen de Oliveira Sá (PB); e Fábio Guedes Gomes (AL).Subcomitê de Vacinas - Comitê Científico do Nordeste
Sinval Brandão Filho, Eduardo Jorge Fonseca, Rafael Dhalia, Ernesto Marques Jr, Carlos Costa e Ivo Castelo Branco
( da redação com informações de assessoria. Edição: Genésio Araújo Jr)



 mais vídeos
mais vídeos